Polícia Federal (Química e Farmácia) | Como resolver a análise de uma mistura por espectroscopia UV-VIS?
Olá pessoal, tudo bem? Me chamo Diego Souza, sou professor novo aqui no Estratégia Concursos da área de Química e Perito Criminal. Estou republicando esse artigo porque acredito ser uma boa dica para quem está se preparando para Polícia Federal para os cargos de Perito na área de Química ou de Farmácia, ou outros concursos na área pericial de Polícia Civil ou de Polícia Científica dos estados ou DF.
Em concursos da área pericial e em outros concursos da área de Química e Farmácia, um assunto bastante recorrente é ANÁLISE POR ESPECTROSCOPIA NA REGIÃO DO ULTRAVIOLETA E VISÍVEL (UV-VIS). A maioria das aplicações práticas e exercícios sobre o tema assume que em uma solução analisada por espectroscopia está presente apenas uma substância absorvente. No entanto, em concursos para Perito Criminal, alguns assuntos são cobrados de maneira um pouco mais complexa. Nesse sentido, pode ser cobrado, em sua prova, a análise de uma mistura por espectroscopia, ou seja, a análise de uma solução contendo mais de uma espécie ou substância absorvente… parece complicado né? Fique tranquilo. Vou lhe explicar passo a passo como se resolve esse tipo de questão.
Vamos ver como isso é cobrado no exercício abaixo.
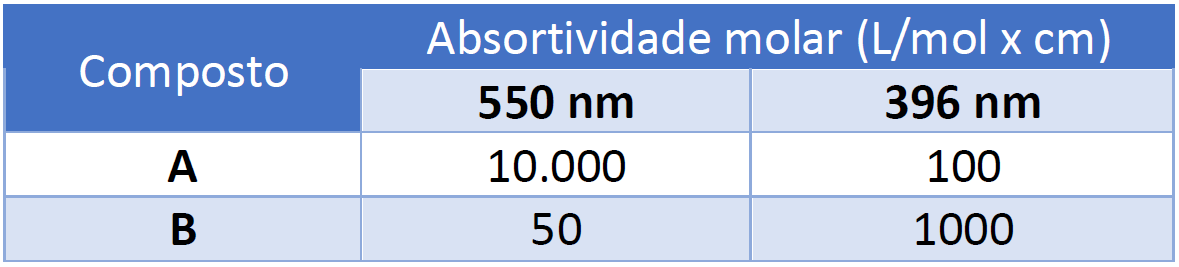
(CESPE|CEBRASPE – Perito Criminal da SDS/PE – 2016) A mistura de dois compostos, A e B, gera um espectro UV-Vis com duas bandas bem resolvidas em 550 nm e 396 nm, com absorbâncias iguais a 0,200 e 0,100, respectivamente. A tabela acima apresentada mostra os dados espectroscópicos para esses dois compostos, nos diferentes comprimentos de onda. Com base nessas informações e considerando-se que essa análise foi feita em uma cubeta com caminho óptico igual 1 cm, é correto afirmar que as concentrações dos compostos A e B nessa mistura são iguais, respectivamente, a
a) 1 × 10-5 mol/L e 5 × 10-5 mol/L.
b) 2 × 10-5 mol/L e 1 × 10-5 mol/L.
c) 4 × 10-5 mol/L e 2 × 10-5 mol/L.
d) 5 × 10-5 mol/L e 1 × 10-5 mol/L.
e) 8 × 10-5 mol/L e 2 × 10-5 mol/L.
Esse é um exercício de aplicação da espectroscopia. Por isso, os conceitos iniciais sobre espectroscopia (radiação eletromagnética, interação luz/matéria e Lei de Lambert-Beer) são pré-requisitos para a sua resolução. Você pode revisar esses conceitos na a AULA 00 do nosso curso, no link abaixo, a qual você pode baixar gratuitamente.
CURSO REGULAR PARA PERITO CRIMINAL (Química) | Endereço para baixar a AULA 00
Vamos realizar uma rápida revisão da Lei de Lambert-Beer que é basilar para espectroscopia e imprescindível para a resolução desse tipo de exercício. Para isso, observe na figura abaixo os cinco componentes principais dos equipamentos espectroscópicos: (1) uma fonte emissora de radiação eletromagnética; (2) um seletor de comprimento de onda que permite a passagem apenas da faixa da luz de interesse para a análise (luz monocromática ou de um só comprimento de onda, λ); (3) um recipiente (cubeta) para amostra; (4) um detector que transforma o sinal luminoso em corrente elétrica; e (5) um processador eletrônico associado a um display de saída de sinal, que, nos equipamentos atuais, pode ser um microcomputador configurado com o software do equipamento.
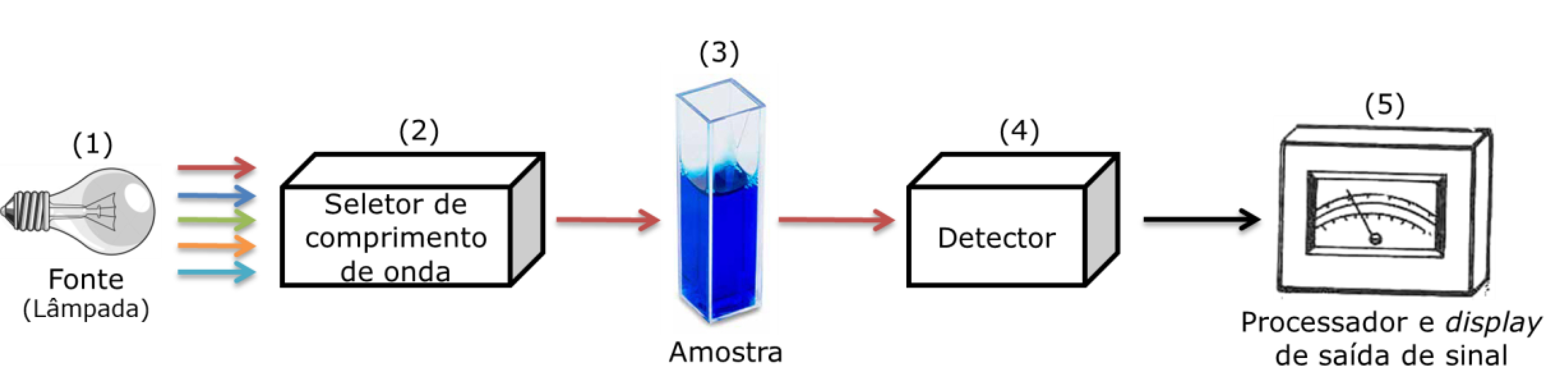
Uma parte da energia do feixe de luz é absorvido pela amostra, quando a luz monocromática, que é específica do método de análise, atravessa a cubeta. Na espectroscopia, um parâmetro indicativo da quantidade de luz absorvida é a Absorbância (Abs). Segundo a Lei de Lambert-Beer, expressa na equação abaixo, a Absorbância (Abs) é diretamente proporcional à concentração (C), à espessura da cubeta (b), e à absortividade (a), que é específica para cada substância analisada e varia de acordo com comprimento de onda(λ).
Abs = a.b.C
Como se vê, a equação original de Lambert-Beer prevê apenas uma substância absorvente e, no exercício em foco, são duas substâncias (A e B) presentes na solução analisada. Para entendermos como devemos contornar essa limitação da equação original, observe na figura abaixo que, para λ menor que 300nm, a absorbância da mistura binária é a soma das absorbâncias individuais das substâncias isonizaida e rifampicina que a constitui.
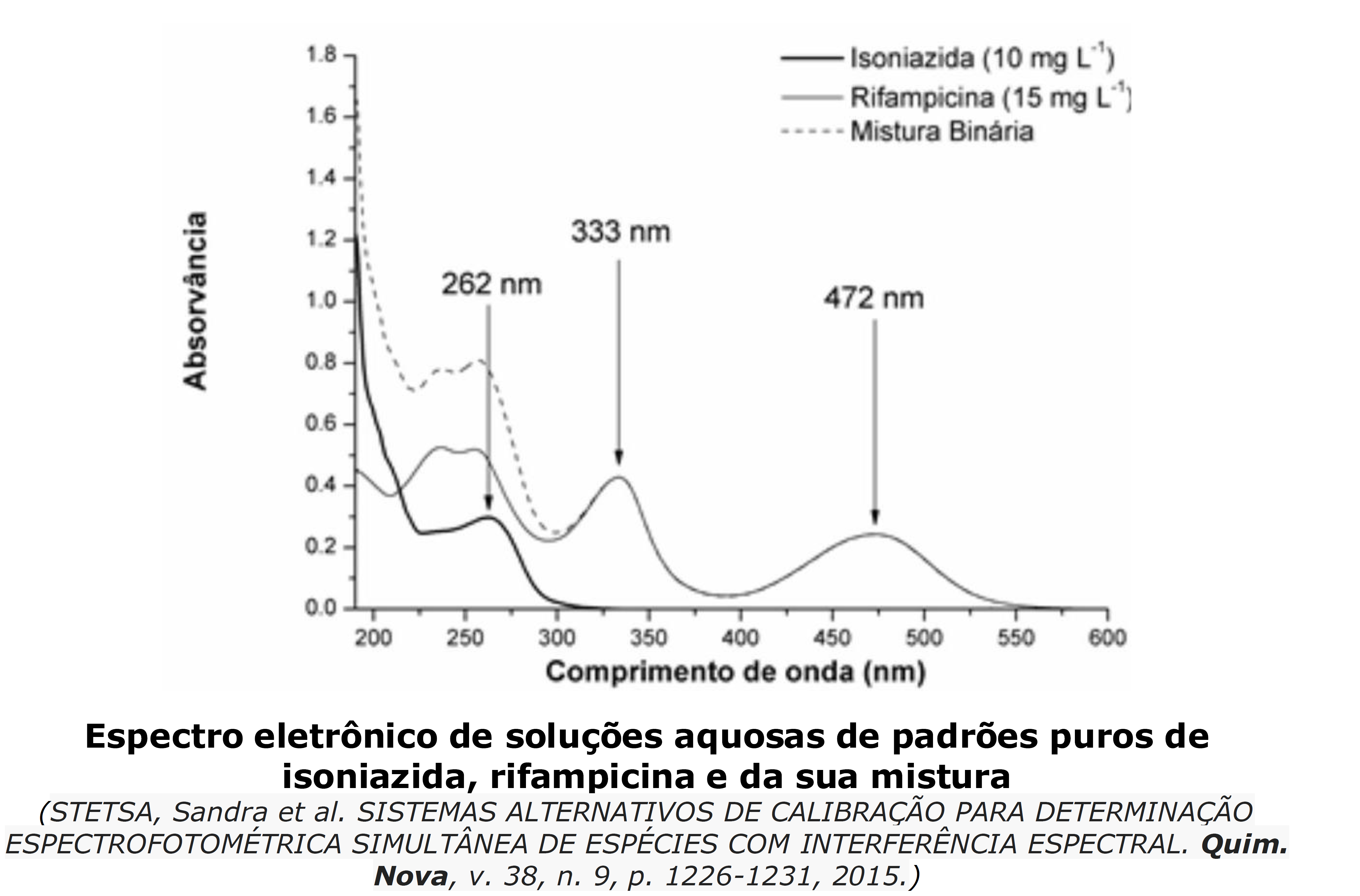
Desta forma, caso haja mais de uma substância absorvente na amostra, a absorbância a um dado λ será a soma das absorbâncias individuais de cada substância:
Absamostra = AbsA + AbsB + … + Absn
Cada parcela de absorbância pode ser escrita pela Lei de Lambert-Beer como
Absn = an.b.Cn
em que an e Cn são respectivamente a absortividade e a concentração da substância n.
Sabendo que as absorbâncias individuais se somam para compor uma absorbância total, podemos estruturar um sistema de duas equações a partir da Lei de Lambert-Beer para dois comprimentos de onda (λ’ e λ”) para a análise de uma mistura com 2 substâncias (A e B):
Absλ’ = aA(λ’).b.CA + aB(λ’).b.CB
Absλ” = aA(λ”).b.CA + aB(λ”).b.CB
Podemos colocar em evidência o termo b para simplificar a equação:
Absλ’ = b.(aA(λ’).CA + aB(λ’).CB)
Absλ” = b.(aA(λ”).CA + aB(λ”).CB)
Temos agora a bagagem necessária para resolução do exercício.
Resolução: a tabela demonstra que ambas substâncias (A e B) apresentam absortividade tanto a 550 nm (λ’) como a 396 nm (λ”’). Desta forma, você deve compreender que as duas bandas bem resolvidas resultam das somas individuais de A e B nos dois comprimentos de onda (λ’, λ”). Por esse motivo, podemos utilizar o sistema de duas equações, estruturado a partir da Lei de Lambert-Beer. Aplicando os valores fornecidos no enunciado e na tabela do exercício, temos:
0,200 = 1,0.(10.000.CA + 50.CB)
0,100 = 1,0.(100.CA + 1000.CB)
Podemos isolar CA na segunda equação e substituir na primeira equação para obter CA:
CB = 9,8.10-5 mol.L-1 ≅ 1,0.10-6 mol.L-1
Em seguida, podemos utilizar qualquer umas das duas equações para obter o valor de CA:
CA = 1,95.10-5 mol.L-1 ≅ 2,0.10-5 mol.L-1
Julgando as alternativas somente por CA, a resposta correta seria letra B. Entretanto, o valor de CB está incorreto. Na publicação preliminar do gabarito, a banca indicou a letra B, mas a questão foi anulada no gabarito oficial.
Gabarito: questão anulada
Confira outra dica valiosa também sobre espectroscopia no artigo Bizu (Química e Farmácia) | Espectroscopia: Espécies orgânicas absorventes na região do UV-VIS.
Essas e outras aplicações da espectroscopia UV-VIS em Perícia Criminal, bem como o funcionamento dos vários instrumentos utilizados em análises espectroscópicas são detalhados na AULA 01 do nosso curso (CURSO REGULAR PARA PERITO CRIMINAL (Química)).
Amanhã postarei uma dica sobre equilíbrio químico (Princípio de Le Châtelier). Passe por aqui para conferir.
Agora, para verificar o seu aprendizado, resolva a questão abaixo e me diga qual a resposta correta. Postem suas dúvidas, perguntas e comentários sobre esse assunto.
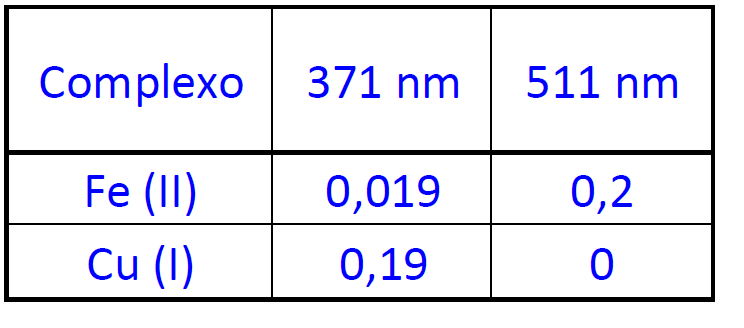
(FCC – An.Ambiental/Químico – SEMAD – 2016) Na determinação de Fe (II) e Cu (I) em uma amostra aquosa, empregou-se o reagente complexante 1,10-fenantrolina, em pH ajustado para 4,5. Os complexos formados apresentaram absorção máxima em 511 nm para o Fe (II) e 371 nm para o Cu (I). Observou-se que a determinação de ferro em 511 nm é isenta da interferência de cobre. Entretanto, em 371 nm ambos os complexos metálicos apresentam absorção. Para a amostra analisada a absorvância medida a 371 nm foi 0,800 e a 511 nm a absorvância foi 0,300. A concentração de Fe (II) e Cu (I) em mg/L, na amostra é, respectivamente:
Dados: caminho óptico = 1cm; unidade das absortividades: (L.mg-1.cm-1).
a) 1,5 e 4,1.
b) 1,5 e 6,7.
c) 0,67 e 4,1.
d) 0,67 e 1,12.
e) 4,1 e 1,5