Polícia Federal (Química e Farmácia) | Princípio de Le Châtelier: como pode ser cobrado?
Olá, tudo certo? Aos que ainda não me conhecem, me chamo Diego, professor de Química e Perito Criminal. Se você está lendo este artigo, talvez esteja se preparando para o concurso da Polícia Federal ou outro na área de química ou farmácia. De certo, tenho uma ótima dica para sua prova.
Um assunto bastante recorrente, em provas de farmácia e química, é o deslocamento de equilíbrio químico, o qual é explicado pelo Princípio de Le Châtelier. Farei uma breve introdução teórica e, em seguida, resolveremos alguns exercícios para que entenda como esse assunto pode ser cobrado de você. Vamos lá?! (Não deixe de ler o final deste artigo, onde menciono outros tópicos específicos sobre equilíbrios químicos que você deve dominar para o concurso da PF).
Princípio de Le Châtelier
Explica o comportamento de sistemas em equilíbrios quando perturbados, podendo ser descrito como segue:
Caso seja realizada uma perturbação em um sistema em equilíbrio, alterando concentrações, temperatura ou pressão, o sistema reagirá se deslocando no sentido de diminuir ou anular essa perturbação.
Talvez não fique tão claro apenas lendo o enunciado do Princípio de Le Châtelier. Vamos analisar isoladamente o que acontece com o sistema em cada tipo de perturbação.
Antes, relembro que, para uma dada reação em equilíbrio,
aA + bB ⇄ cC + dD
podemos escrever uma equação algébrica denominada constante de equilíbrio (K), válida para o estado de equilíbrio, como segue:
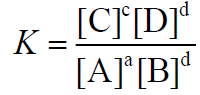
Os termos [A], [B], [C] e [D] representam as concentrações em mol.L-1 das espécies químicas envolvidas ou a pressão em bar dos gases envolvidos.
Alteração de concentração
Retomemos a equação genérica anterior A + B ⇄ C + D. Imagine que seja retirada parte dos produtos (C e D) do sistema. Nesse caso, a reação irá se deslocar no sentido de formação de mais produto (seta para direita) a fim de reequilibrar o sistema. Da mesma forma, se for retirado os reagentes ou diminuída suas concentrações, então a reação se deslocará no sentido dos reagentes (seta para esquerda).
De outra maneira, se adicionarmos reagentes a um sistema em equilíbrio, ele reagirá no sentido de formação de mais produtos. Caso a adição seja de produtos, então o equilíbrio será deslocado para os reagentes.
Alteração de temperatura
Uma reação endotérmica (∆H(variação de entalpia)>0) recebe ou rouba energia do meio (vizinhança) para ocorrer. Para esse tipo de reação, o aquecimento do meio (aumentar a temperatura) favorece a reação direta e, portanto, desloca no sentido dos produtos. De forma oposta, uma reação exotérmica (∆H<0) será deslocada para o sentido dos produtos caso o meio seja resfriado.
Uma outra maneira de analisarmos esse tipo deslocamento é considerarmos que a energia fornecida ou absorvida na forma de calor é parte da reação, conforme demonstrado abaixo. Perceba:
Reação exotérmica: Reagentes ⇄ Produtos + Calor
Reação endotérmica: Calor + Reagentes ⇄ Produtos
A partir daí podemos usar o raciocínio da concentração. Por exemplo, nas reações exotérmicas, caso o meio seja aquecido, é como se tivéssemos a adição de um dos produtos (calor) e, por isso, a reação será deslocada para os reagentes. A aplicação de aquecimento em uma reação endotérmica promoverá um deslocamento do equilíbrio para a formação de produtos.
Alteração da pressão
Devemos lembrar que idealmente todos os gases possuem o mesmo volume molar de 22,4L.mol-1 nas CNTP (Condições Normais de Temperatura e Pressão). Tomemos como exemplo a síntese da amônia para entendermos o efeito da pressão sobre o equilíbrio.
N2(g) + 3 H2(g) ⇄ NH3(g)
Mesmo que o sistema não esteja nas CNTP, idealmente 1 mol de um determinado gás ocupa o mesmo volume que 1 mol de outro gás. Desta forma, vamos considerar que cada mol de gás ocupe um certo volume V. Na reação, 1V de N2 e 3V de H2 produzem 2V de NH3. De outra forma, somando o volume dos reagentes, temos 4V D 2V. Disso nota-se que os reagentes ocupam um volume maior que o produto nessa reação de síntese da amônia. Caso a pressão do sistema reacional fosse aumentada, ou seja, se o sistema fosse comprimido, então o equilíbrio seria deslocado no sentido de menor volume, que nesse caso seria na direção dos produtos. De modo oposto, se a pressão for diminuída, o equilíbrio será deslocado na direção de maior volume, no caso, para os reagentes.
Como já dito, o princípio de Lê Châtelier é assunto muito cobrado em exercícios de concurso. Vamos ver como isso se dá? Fique atento à resolução da próxima questão, na qual introduzo o conceito de quociente da reação para complementar a interpretação do princípio de Lê Châtelier.
Exercícios
Texto referente à questão 01:
Considere que, na temperatura T0, a constante de equilíbrio para a reação de decomposição do N2O4 (g) apresentada a seguir seja igual a 4,0 e que o comportamento dos gases envolvidos nessa reação seja ideal.
N2O4 (g) + calor ⇄ 2NO2 (g)
01- (CESPE|CEBRASPE – Perito Criminal/Química, Química Industrial ou Eng. Química – SDS/PE – 2016) De acordo com as informações do texto acima, se, em determinado instante, na temperatura T0, as pressões parciais de N2O4 (g) e NO2 (g) dentro de uma câmara forem iguais a 0,16 bar e 0,80 bar, respectivamente, então
- a reação não se encontrará em equilíbrio, mas as velocidades das reações direta e inversa serão iguais e diferentes de zero.
- a reação se encontrará em equilíbrio, e a velocidade tanto da reação direta quanto da reação inversa será igual a zero.
- a reação se encontrará em equilíbrio, e as velocidades das reações direta e inversa serão iguais.
- a reação não se encontrará em equilíbrio, e a velocidade da reação direta será superior à da reação inversa.
- a reação não se encontrará em equilíbrio, e a velocidade da reação inversa será superior à da reação direta.
Resolução: inicialmente devemos utilizar os dados da reação para escrever a equação da constante de equilíbrio.
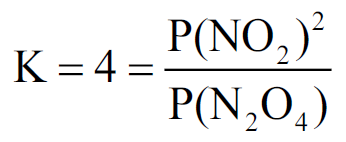
em que P corresponde a pressão em bar. Precisamos agora descobrir se o sistema está em equilíbrio com as pressões parciais fornecidas. Podemos calcular o quociente de reação (Q) e em seguida compará-lo com K. O Q é calculado de maneira semelhante ao K, mas difere deste por apresentar a condição real ou atual do sistema ou da reação. Vejamos como calculá-lo.
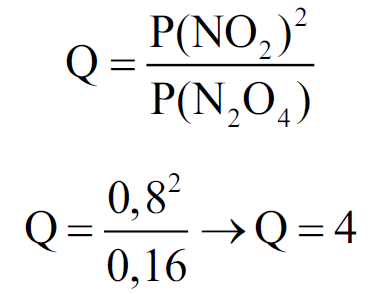
Comparação entre Q e K (Empregue este raciocínio em outros exercícios quando precisar).

Como Q=K, concluímos que o sistema se encontra em equilíbrio e, portanto, as velocidades das reações direta e inversa serão iguais.
Gabarito: letra C
02- (VUNESP – Perito Criminal – PCSP – 2013) O aumento de pressão do sistema acarretará maior rendimento em produto do equilíbrio representado por:
- CaCO3 (s) ⇄ CaO(s) + CO2 (g)
- CO(g) + ½ O2(g) ⇄ CO2(g)
- C(s) + O2 (g) ⇄ CO2(g)
- N2O4(g) ⇄ N2(g) + 2O2(g)
- H2O(L) ⇄ H2O(g)
Resolução: considere que cada mol de gás, independente da substância gasosa, ocupe o mesmo volume V. Faça a soma dos volumes para os reagentes e para os produtos em cada reação. Veja:
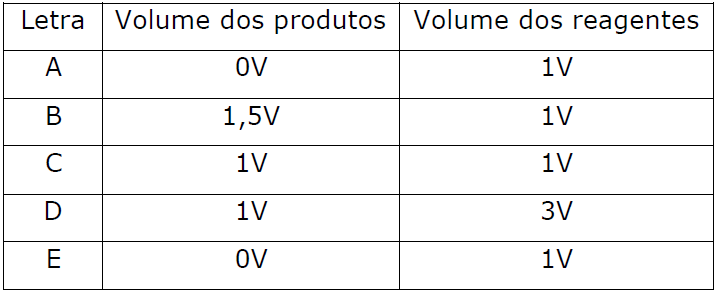
Nas reações em que os volumes dos lados opostos da reação são iguais, a variação da pressão não deve causar deslocamento do equilíbrio. Nos demais, o equilíbrio será deslocado na direção de menor volume caso haja aumento de pressão. Vale lembrar que o enunciado quer saber qual reação aumentaria seu rendimento (aumentaria a formação de produtos) com o aumento da pressão. Segundo a tabela acima, a reação da Letra B é a única em que os produtos ocupam um volume menor que os produtos.
Gabarito: letra B
03- (IBFC – Perito Criminal/Eng. Química – PCRJ – 2013) A corrosão pode ter inúmeras causas, entre elas podemos citar os incêndios. Quando o fenômeno ígneo ocorre em edificações ou viadutos, pode colocar em risco a integridade física e o patrimônio dos cidadãos. Nos processos de corrosão do Ferro, há formação de ferrugem e, dependendo dos fatores que contribuem para este processo, pode-se minimizar ou até evitar o processo corrosivo. Na equação da reação abaixo está representado uma das formas de oxidação do ferro.
![]()
Marque a alternativa que apresenta o correto procedimento para dificultar este processo de corrosão:
- Retirar óxido férrico.
- Adicionar hidrogênio gasoso.
- Adicionar ferro metálico.
- Alterar a pressão do sistema reacional.
- Adicionar água.
Resolução: o candidato deveria se basear no princípio de Lê Châtelier para julgar todas as alternativas.
- Letra A: incorreta. Retirar óxido férrico (Fe2O3), que é um produto, desloca a reação para a direita, promovendo ainda mais a oxidação do ferro metálico (Fe).
- Letra B: correta. Adicionar hidrogênio gasoso, que é um produto, desloca a reação no sentido dos reagentes, evitando, dessa forma, a oxidação do ferro metálico e a formação de ferrugem (Fe2O3).
- Letra C: incorreta. Adicionar reagente desloca a reação para a formação dos produtos.
- Letra D: incorreta. Do lado dos reagentes há 3 mols de H2O(g), enquanto que do lado dos produtos há 3 mols de H2(g). Considerando um comportamento ideal, os 3 mols dos diferentes gases ocuparão o mesmo volume. Portanto, como não há diferença de volume entre os dois lados da equação, o equilíbrio independerá da pressão.
- Letra E: incorreta. Adicionar reagente desloca a reação para a formação dos produtos.
Gabarito: letra B
04- (FGV – Professor/Química – SEDUC-AM – 2014) O cloreto de bromo (BrCl) é um gás amarelado e instável, utilizado como desinfetante nos sistemas de resfriamento das indústrias. Em um sistema fechado foi estabelecido o seguinte equilíbrio entre o cloreto de bromo e os produtos de sua degradação:
2BrCl(g) ⇄ Cl2(g) + Br2(g)
Para este equilíbrio foram determinadas, experimentalmente, as seguintes constantes:
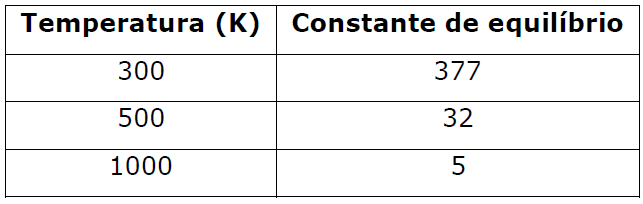
Considerando o Princípio de Le Chatelier, o fator que desloca este equilíbrio, favorecendo a produção de cloro, é
- adição de catalisador.
- aumento da pressão total.
- diminuição da temperatura.
- aumento da concentração de Br2.
- aumento da pressão parcial de Cl2.
Resolução: exercício interessante por exigir do candidato uma linha de raciocínio um pouco diferente. A tabela demonstra que quanto maior a temperatura, menor é a constante de equilíbrio. Isso significa que com o aumento da temperatura, o equilíbrio está sendo deslocado no sentido dos reagentes. Pois bem, disso, concluímos que a reação é exotérmica, a qual pode ser representada de forma genérica por:
Reagentes ⇄ Produtos + Calor
Correlacionando o princípio de Lê Châtelier com a equação acima, temos que a formação do cloro, que é um produto, será favorecida com a retirada de calor (diminuição da temperatura) do meio reacional.
Gabarito: letra C
05- (IF-RS – Professor – Química/Química Analítica – IF-RS – 2015) Com relação ao equilíbrio químico e aos fatores que o deslocam, assinale a alternativa CORRETA.
- Se a constante de equilíbrio K, for alta, então a formação dos produtos é desfavorecida, e quando a mesma for baixa, a formação dos produtos é favorecida.
- A compressão de uma mistura reacional no equilíbrio tende a deslocar a reação na direção em que reduz o número de moléculas em fase líquida.
- Aumentando a temperatura de uma reação exotérmica, ocorre um favorecimento da formação de produtos; e aumentando a temperatura de uma reação endotérmica, ocorre um favorecimento da formação de reagentes.
- Segundo o princípio de Le Chatelier, quando um produto é adicionado a um sistema em equilíbrio, a reação tende a formar reagentes. Quando um produto é removido, mais produto é formado.
- Quando uma quantidade de reagente é adicionada a um sistema em equilíbrio, a constante de equilíbrio aumenta, favorecendo a formação dos produtos.
Resolução: exercício sobre o princípio de Lê Châtelier.
- Letra A: incorreta. A formação dos produtos será favorecida quando K for elevado (basta lembrar que os produtos estão no numerador da equação de K).
- Letra B: incorreta. O examinador não deixa claro a qual tipo de equilíbrio está se referindo, mas fica subentendido que é um equilíbrio entre fase líquida e gasosa, do tipo A(l) ⇄ A(g). Nesse tipo de equilíbrio, a compressão (aumento da pressão total) desloca o equilíbrio na direção da forma líquida, que ocupa menos volume, aumentando, desta forma, o número de moléculas em fase líquida.
- Letra C: incorreta. Para uma reação exotérmica temos: Reagentes ⇄ Produtos + CalorCaso haja aquecimento externo, o equilíbrio será deslocado no sentido de formação de reagentes. De forma oposta, sendo aquecida, a reação endotérmica seria deslocada para a formação de produtos.
- Letra D: correta. Enunciado de acordo com o que estudamos.
- Letra E: incorreta. A constante de equilíbrio não se altera com a adição ou subtração de reagentes ou produtos. Por este motivo recebe o nome de constante.
Gabarito: letra D
Outros Bizus sobre equilíbrio
O CESPE costuma cobrar não só no Princípio de Le Châtelier, mas vários outros tópicos dentro de equilíbrios químicos. Listo abaixo alguns tópicos que costumam dar trabalho para os candidatos e que você precisa dominar para o concurso da Polícia Federal:
- equilíbrio sistemático;
- cálculo da concentração de todas as espécies em soluções de ácidos e bases fracos;
- espécies dipróticas (ácido e bases);
- identificação de espécie principal;
- soluções tampão e equação de Henderson-Hasselbalch;
- titulações ácido/base;
- titulação com EDTA.
DICA: em exercícios sobre equilíbrio químico, desconfie sempre que os cálculos parecerem muito extensos. O desenvolvimento matemático de alguns exercícios produzem equações de 2º e 3º grau. Nunca tente resolver equações de 3º e tenha a consciência de que, quase sempre, não será necessário resolver equações de 2º grau. Isso porque o examinador possui consciência de que isso seria impraticável para um curto tempo de prova. Nesses casos, ele provavelmente espera que você faça alguma(s) aproximação(ões) válida(s) para encontrar a resposta mais rapidamente.
Nas AULAS 04 e 05 do CURSO REGULAR PARA PERITO CRIMINAL (Química), discuto detalhadamente cada um dos tópicos acima e também detalho, em quais situações, devemos fazer as aproximações para fugir de cálculos complexos e agilizar a resolução dessas questões. No mesmo link, vocês podem baixar e ler a aula demonstrativa do curso.
Confiram outras dicas nos artigos abaixo:
Bizu (Química e Farmácia) | Espectroscopia: Espécies orgânicas absorventes na região do UV-VIS.
Polícia Federal (Química e Farmácia) | Como resolver a análise de uma mistura por espectroscopia UV-VIS?
Vou ficando por aqui. Em breve, postarei mais dicas.